SEJARAH KIMIA ORGANIK
Apakah
kimia organik itu? Mengapa begitu banyak orang mempelajari kimia organik dan
mengapa pula kita perlu mempelajarinya? Jawabannya sangat sederhana, karena
semua organisme hidup tersusun atas senyawa-senyawa organik. Sebagai contohnya,
rambut yang menghias kepala kita, kulit, otot, dan DNA yang mengontrol
penurunan genetik, serta obat, semuanya merupakan senyawa organik.
Sejarah
tentang kimia organik diawali sejak pertengahan abad 17. pada waktu itu, tidak
dapat dijelaskan perbedaan antara senyawa yang diperoleh dari organisme hidup
(hewan dan tumbuhan) dengan senyawa yang
diperoleh dari bahan-bahan mineral. Senyawa yang diperoleh dari tumbuhan dan
hewan sangat sulit diisolasi. Ketika dapat dimurnikan, senyawa-senyawa yang
diperoleh tersebut sangat mudah terdekomposisi dari pada senyawa yang diperoleh
dari bahan - bahan mineral. Seorang ahli kimia dari Swedia, Torbern Bergman,
pada tahun 1770 mengekspresikan penjelasan di atas sebagai perbedaan antara
senyawa organik dan anorganik. Selanjutnya, senyawa organik diartikan sebagai
senyawa kimia yang diperoleh dari makhluk hidup.
Lemak hewani NaOH Sabun + Gliserin
H2O
Beberapa tahun kemudian, teori
vitalitas semakin melemah ketika Friedrich Wohler (1828) mampu mengubah
garam anorganik, ammonium sianat, menjadi senyawa organik yaitu urea yang sebelumnya
telah ditemukan dalam urin manusia. urea
(suatu komponen urin) dapat dibuat dengan menguapkan larutan yang berisi
senyawa anorganik amonium sianat.
Atom
terpenting yang dipelajari dalam kimia organik adalah atom karbon. Meskipun
demikian, atom lainnya juga dipelajari seperti hidrogen, nitrogen, oksigen,
fosfor, sulfur, dan atom lainnya. Akan tetapi mengapa atom karbon sangat
spesial? Atom karbon merupakan termasuk dalam golongan 4A, karbon memiliki
empat elektron valensi yang dapat digunakan untuk membentuk empat ikatan
kovalen. Di dalam tabel periodik, atom karbon menduduki posisi tengah dalam kolom
periodenya. Atom di sebelah kiri karbon memiliki kecenderungan memberikan
elektron sedangkan di sebelah kanannya memiliki kecenderungan menarik elektron.
KLASIFIKASI SENYAWA ORGANIK
Senyawa
hidrokarbon adalah senyawa yang terdiri dari atom karbon (C) dan atom hidrogen
(H). Seluruh hidrokarbon memiliki rantai karbon dan atom-atom hidrogen yang
berikatan rantai-rantai tersebut. Misal jika rantai karbonnya terbuka disebut
senyawa karbon alifatik seperti hidrokarbon golongan alkana, alkena dan alkuna
sedangkan rantai karbonnya tertutup disebut senyawa karbon alisiklik seperti
senyawa siklopentana dan aromatik seperti senyawa benzena. Atom karbon (C)
dengan nomor atom 6 mempunyai susunan elektron K=2 dan L=4. Atom karbon
mempunyai 4 elektron valensi dan dapat membentuk empat ikatan kovalen. Sebagai
contoh, molekul CH4 (metana) yang memiliki diagram yang cukup sederhana dibawah
ini.
Gambar 1.
Empat ikatan kovalen dari molekul metana
Atom
karbon juga dapat membentuk ikatan dengan atom karbon lain untuk membentuk
rantai karbon yang terbuka, bercabang dan tertutup. Kini kita dapat mulai
membuat klasifikasi hidrokarbon, yang merupakan senyawa yang hanya tersusun
oleh karbon dan hidrogen. Senyawa-senyawa karbon lainnya dapat dipandang
sebagai turunan dari hidrokarbon ini. Hidrokarbon dapat dibagi menjadi dua
kelompok utama: hidrokarbon alifatik dan hidrokarbon siklik.
a.
Rantai karbon alifatis atau alifatik, adalah rantai karbon terbuka. Rantai
karbon alifatis ini bisa lurus dan bisa juga bercabang.
Contoh
Rantai karbon alifatik :
b.
Rantai karbon siklis atau siklik, adalah rantai karbon tertutup. Dibedakan atas
karbosiklik dan heterosiklik.
1)
Karbosiklik adalah senyawa karbon siklik yang rantai lingkarnya hanya terdiri
dari atom C saja. Yang termasuk karbosiklik adalah senyawa aromatis dan
alisiklik.
a)
Senyawa aromatis atau aromatik adalah senyawa karbosiklik yang terdiri atas 6
atom karbon atau lebih yang memiliki ikatan rangkap 2 terkonjugasi.
Contoh
Senyawa aromatik :
b)
Senyawa alisiklik adalah senyawa karbosiklik yang hanya mempunyai ikatan
tunggal.
Contoh
Senyawa alisiklik :
2)
Senyawa heterosiklik adalah senyawa karbosiklik yang di dalam rantai lingkarnya
terdapat atom lain selain atom karbon.
Contoh Senyawa
heterosiklik :
Karena senyawa hidrokarbon terdiri atas karbon
dan hidrogen, maka salah satu bagian dari ilmu kimia yang membahas segala
sesuatu tentang senyawa hidrokarbon disebut kimia karbon. Dulu
ilmu kimia karbon disebut kimia organik, karena senyawa-senyawanya
dianggap hanya dapat diperoleh dari tubuh makhluk hidup dan tidak dapat
disintesis dalam pabrik.
Setelah
keberhasilan Wohler membuat senyawa karbon, banyaklah sarjana lain yang mencoba
membuat senyawa karbon dari senyawa anorganik. Lambat laun teori tentang arti hidup
hilang dan orang hanya menggunakan kimia organik sebagai nama saja tanpa
disesuaikan dengan arti yang sesungguhnya. Sejak saat itu banyak senyawa karbon
berhasil disintesis dan hingga sekarang lebih dari 2 juta senyawa karbon dikenal
orang dan terus bertambah senyawa setiap harinya.
PERBEDAAN SENYAWA ORGANIK DAN ANORGANIK
PERBEDAAN SENYAWA ORGANIK DAN ANORGANIK
Kimia
organik merupakan mata pelajaran yang berisi tentang struktur, sifat,
komposisi, reaksi, dan sintesis senyawa organik. Tahukan Anda perbedaan senyawa
organik dan anorganik ? Senyawa organik tersusun dari karbon dan hidrogen, dan
dapat mengandung unsur-unsur lain seperti nitrogen, oksigen, fosfor, dan
belerang. Senyawa organik adalah senyawa kimia yang molekulnya mengandung
karbon, kecuali karbida, karbonat, dan oksida karbon. Pembeda kimia organik dan
anorganik adalah ada-tidaknya ikatan karbon-hidrogen, sehingga asam format,
asam lemak termasuk senyawa organik sedangkan asam karbonat termasuk anorganik.
REAKSI KIMIA ORGANIK
Kimia organik adalah studi tentang karakteristik, mekanisme, reaksi dan
struktur bahan organik, yaitu senyawa yang mengandung atom karbon dalam
berbagai bentuk. Senyawa organik membentuk struktur dasar dari kehidupan di
Bumi dan memiliki struktur yang bervariasi. Mereka sangat beragam, maka reaksi
dari senyawa ini secara luas diklasifikasikan menjadi 4 kategori.
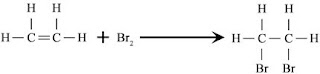
1. Reaksi
Samping (Adisi)
Reaksi Adisi bromin
Reaksi Adisi hidrogen sianida
Sebuah atom atau sekelompok atom ditambahkan ke
molekul. Reaksi ini kebanyakan melibatkan senyawa tak jenuh (senyawa yang
mengandung ikatan ganda atau ikatan rangkap tiga antara atom) seperti alkena,
alkuna atau keton. Reaksi samping juga disebut reaksi jenuh karena atom karbon
jenuh terpasang dengan jumlah maksimum kelompok. Hal ini dilakukan dengan
memecah ikatan dua atau tiga di antara atom untuk mengakomodasi atom tambahan
atau kelompok atom dalam molekul.Sebagai contoh, bromin menambah etilen untuk membentuk 1,2-Dibromoethane.
Demikian pula,hidrogen sianida menambah etanal untuk membentuk
2-hydroksipropannitril.
2 2. Reaksi
Penghapusan (Eliminasi)
Reaksi dehidrasi
Reaksi dehidrohalogenasi
Reaksi eliminasi melibatkan penghapusan atom atau
kelompok atom dari molekul. Ini adalah proses di mana senyawa jenuh akan
dikonversi ke senyawa tak jenuh. Hal ini dilakukan biasanya melalui aksi asam,
basa, logam atau panas. Reaksi eliminasi adalah kebalikan dari reaksi adisi.
Mereka dikenal dengan atom atau kelompok atom yang meninggalkan molekul.
Dehidrohalogenasi: – penghapusan hidrogen dan halogen
Dehidrasi: – meninggalkan molekul air
Dehidrogenasi: – penghapusan hidrogen
Yang pertama adalah contoh dari dehidrasi dimana air dihilangkan dari
sikloheksanol untuk membentuk sikloheksen di hadapan asam kuat, H2SO4.
Reaksi lainnya adalah contoh dehidrohalogenasi bromoetana untuk membentuk
etilen.
3.Reaksi
Pergantian (Substitusi)
Reaksi substitusi amino
Reaksi substitusi klorin
Ini adalah kelas reaksi kimia di mana atom, ion atau kelompok atom/ion
diganti dengan kelompok ion lain, atom atau kelompok fungsional. Misalnya,
gugus amino (NH2) pengganti klorin dari asetil klorida untuk
membentuk asetamida. Klorin pengganti hidrogen dalam metana untuk membentuk
klorometana.
4 4.Isomerisasi
atau Reaksi Penataan ulang
penataan ulang siklopropana
Ini adalah proses kimia dimana senyawa menata kembali menjadi bentuk
isomernya. Isomer adalah senyawa dengan berat molekul dan komposisi yang sama
tetapi berbeda dalam struktur dan konfigurasi mereka.
Di sini, siklopropana menata kembali ke propena. 2-butena adalah alkena
dengan empat atom C yang ada sebagai dua isomer geometri masing-masing
trans-2-butena dan cis-2-butena. Karena perbedaan ini, sifat kimia dan fisika
berubah. Reaksi Pericyclic juga merupakan jenis reaksi penataan ulang.
PERMASALAHAN
Mengapa
pada reaksi eliminasi biasanya dilakukan dalam suasana asam ataupun basa? Bagaimanakah
jika tidak dalam suasana asam ataupun
basa apakah reaksi eliminasi masih dapat berlangsung?













Assalamualaikum wr.wb
BalasHapusSaya aminah NIM RSA1C114015
Yang saya baca Reaksi eliminasi adalah suatu jenis reaksi organic dimana dua substituent dilepaskan dari sebuah molekul. Reaksi satu langkah disebut dengan eliminasi2 ( E2). E 2 merupakan reaksi eliminasi biomulekuler. Rekasi ini hanya terdiri dari satu langkah mekanisme dimana ikatan karbon – hydrogen dan karbon – halogen terputus membentuk ikatan rangkap C = C. reaksi ini dilangsungkan oleh alkil halide primer dan sekunder. Reaksi E2 secara khusus menggunakan basa kuat untuk menarik hydrogen asam dengan kuat.
terimakasih semoga bermanfaat
Assalamualaikum wr. wb
BalasHapussaya Putri Bungsu dengan NIM RSA1C114010 ingin sedikit menambahkan. Dari literatur yang saya baca.
E1 merupakan reaksi eliminasi unimolekuler. E1 terdiri dari dua langkah mekanisme yaitu ionisasi dan deprotonasi. Ionisasi adalah putusnya ikatan karbon – halogen membentuk intermediet karbokation. Reaksi E1 biasnya terjadi pada alkil halide tersier. Reaksi ini berlangsung tanpa kuat, melainkan dengan basa lemah ( dalam suasana asam dan suhu tinggi ). Menurut pendapat saya apabila tidak dilakukan dalam suasana asam ataupun basa maka reaksi eliminasi tersebut tidak dapat berlangsung.
sekian, semoga dapat membantu.
Assalamualaikum wr wb saudari ririn, Saya Rini Alfiah As dengan NIM RSA1C114011 ingin mencoba menjawab permasalahan saudari ririn, menurut artikel yang saya baca..
BalasHapusBila alkil halida yang mempunyai atom H direaksikan dengan basa kuat, akan terjadi reaksi eliminasi dan terbentuk alkena. Karena proton yang dihilangkan terletak pada kedudukan terhadap halogen, maka reaksi ini disebut eliminasi Bila X adalah halogen, maka reaksi ini disebut dehidrohalogenasi. Eliminasi dapat pula terjadi bila X adalah gugus lepas yang baik, misalnya –OSO2R, -SR2 dan -SO2R.
Semoga Membantu :)